JURNAL
PRAKTIKUM
KIMIA
ORGANIK I
NAMA : RESA OVELIA HAMSAR
NIM : A1C118034
DOSEN
PENGAMPU :
Dr.Drs.
SYAMSURIZAL, M.Si.
PROGRAM
STUDI PENDIDIKAN KIMIA
JURUSAN
PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
FAKULTAS
KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS
JAMBI
2020
Percobaan
4
I. Judul
: Reaksi-reaksi
Hidrokarbon
II. Hari/ Tanggal : Rabu,
4 Februari 2020
III.
Tujuan : Adapun percobaan
ini bertujuan untuk :
1.
Dapat memaparkan perbedaan sifat-sifat kimia
hidrokarbon alifatik jenuh dan tak jenuh dan aromatik.
2.
Dapat memaparkan jenis reaksi kimia
untuk membedakan ketiga golongan senyawa hidrokarbon
3.
Dapat mengetahui cara dan teknik
pengujian ketiga golongan senyawa hidrokarbon.
IV.
Landasan Teori
Untuk senyawa hidrokarbon biasanya
tersusun dari atom hidrogen dan karbon yang lazimnya disebut dengan alkana,
alkena, dan alkuna. Senyawa ini banyak terdapat dalam kehidupan sehari-hari
contohnya pada saat memasak dan bahan bakar kendaraan. Pada senyawa hidrokarbon reaksi-reaksinya
dapat terjadi secara tidak sempurna dan sempurna. Kedua reaksi ini dapat
diamati melalui analisis dari proses berlangsung dan hasil dari reaksi.
Senyawa hidrokarbon
yang paling dasar adalah alkana, merupakan senyawa hidrokarbon yang memiliki
ikatan kovalen tunggal dan struktur molekulnya tersusun atas hidrogen dan
karbon. Senyawa alkana yang paling sederhana adalah metana, yang berupa gas pada
suhu dan tekanan yang baku serta komponen utama penyusun gas (Wilbraham, 1992).
Pengklasifikasian
hidrokarbon dapat dilakukan berdasarkan ikatan karbon pada senyawa. Ada dua
macam pengelompokkan, hidrokarbon jenuh dan hidrokarbon tak jenuh. Hidrokarbon
jenuh merupakan hidrokarbon yang molekul karbonnya memiliki satu ikatan dan
hidrokarbon tak jenuh adalah hidrokarbon yang molekul karbonnya memiliki ikatan
rangkap (Fessenden, 1997).
Menurut Louis (1964)
terdapat beberapa sifat senyawa hidrokarbon antaralain:
1.
Senyawa
hidrokarbon bersifat non polar yang menyebabkannya tidak bisa larut dalam air.
2.
Peningkatan titik
didih berbanding lurus dengan peningkatan jumlah atom C. Semakin banyak atom C
makan akan semakin tinggi titik didihnya.
3.
Senyawa
hidrokarbon dapat berupa padat, cair dan gas berdasarkan jumlah atom C dan H
yang dikandung.
4.
Pereaksian
dengan Halogen dapat menyebabkan reaksi substitusi pada salah satu atom H
senyawa Hidrokarbon.
5.
Reaksi oksidasi pada alkana dapat menghasilkan
energi.
Berdasarkan
strukturnya, hidrokarbon dapat dikelompokkan menjadi hidrokarbon alifatik dan aromatik.
Untuk hidrokarbon alifatik berasal dari minyak bumi dan hidrokarbon aromatik berasal
dari batu bara. Seluruh senyawa dari hidrokarbon alifatik maupun aromatik
bersifat tak larut dalam air dan dapat terbakar bila bereaksi dengan udara
(Ridwan, 1989).
V.
Alat dan Bahan
5.1 Alat
Alat
yang digunakan pada praktikum ini yaitu:
1. Pipet
tetes
2. Kardus
3. Tabung
Reaksi
4. Gelas
Kimia
5. Termometer
6. Lampu
Pijar
7. Kaki
Tiga
8. Bunsen
9. Batu
Didih
10. Lemari
Asam
11. Kawat
Kasa
1.2 Bahan
Bahan
yang digunakan pada praktikum ini yaitu:
1. Kertas
Lakmus
2. Asam
Nitrat
3. Senyawa
tak dikenal
4. Liogroin
5. Asam
Sulfat Pekat
6. Sikloheksana
7. Benzen
8. Aquades
9. Potongan
Besi
10. Kalium
Permanganat
11. CCl4
VI.
Prosedur Kerja
6.1 Brom dalam Karbon tetraklorida
6.2 Brom
6.3 Larutan Kalium Permanganat
6.4 Asam Sulfat Pekat
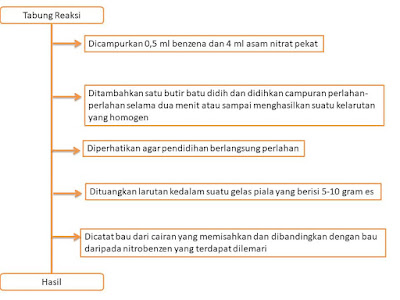
6.5 Asam Nitrat
6.6 Senyawa tak dikenal
Untuk video percobaan dapat dilihat pada link berikut:
Pertanyaan:
1. Mengapa terjadi pemisahan pada saat percobaan?
2. Apakah cara pendemonstran melakukan percobaan sudah benar pada video?
3. Dalam pelarut apa sajakah bromin dapat larut?